Fachklinik
Bad Füssing
Studien, Literatur & weiterführende Detailinformationen
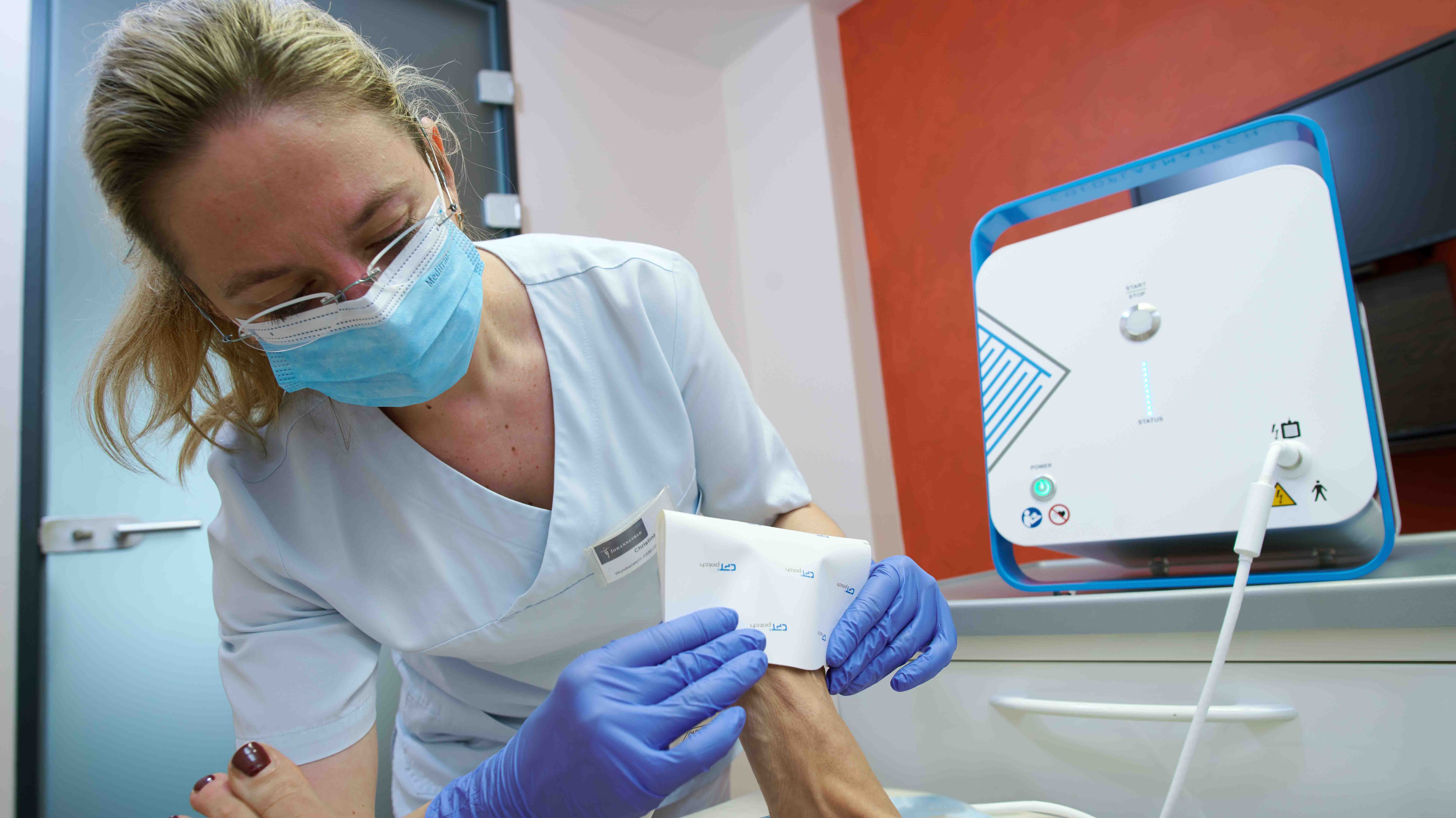
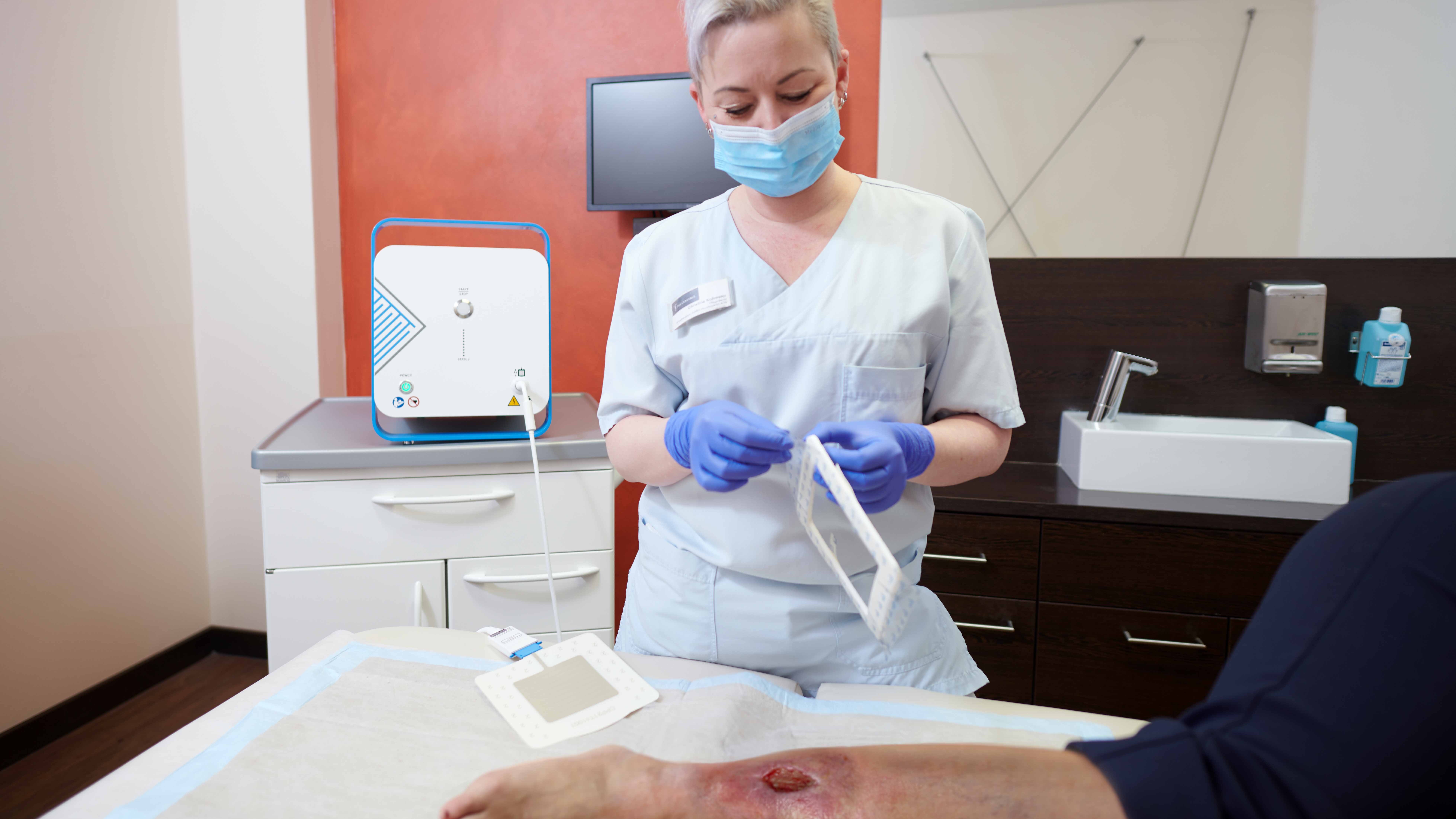
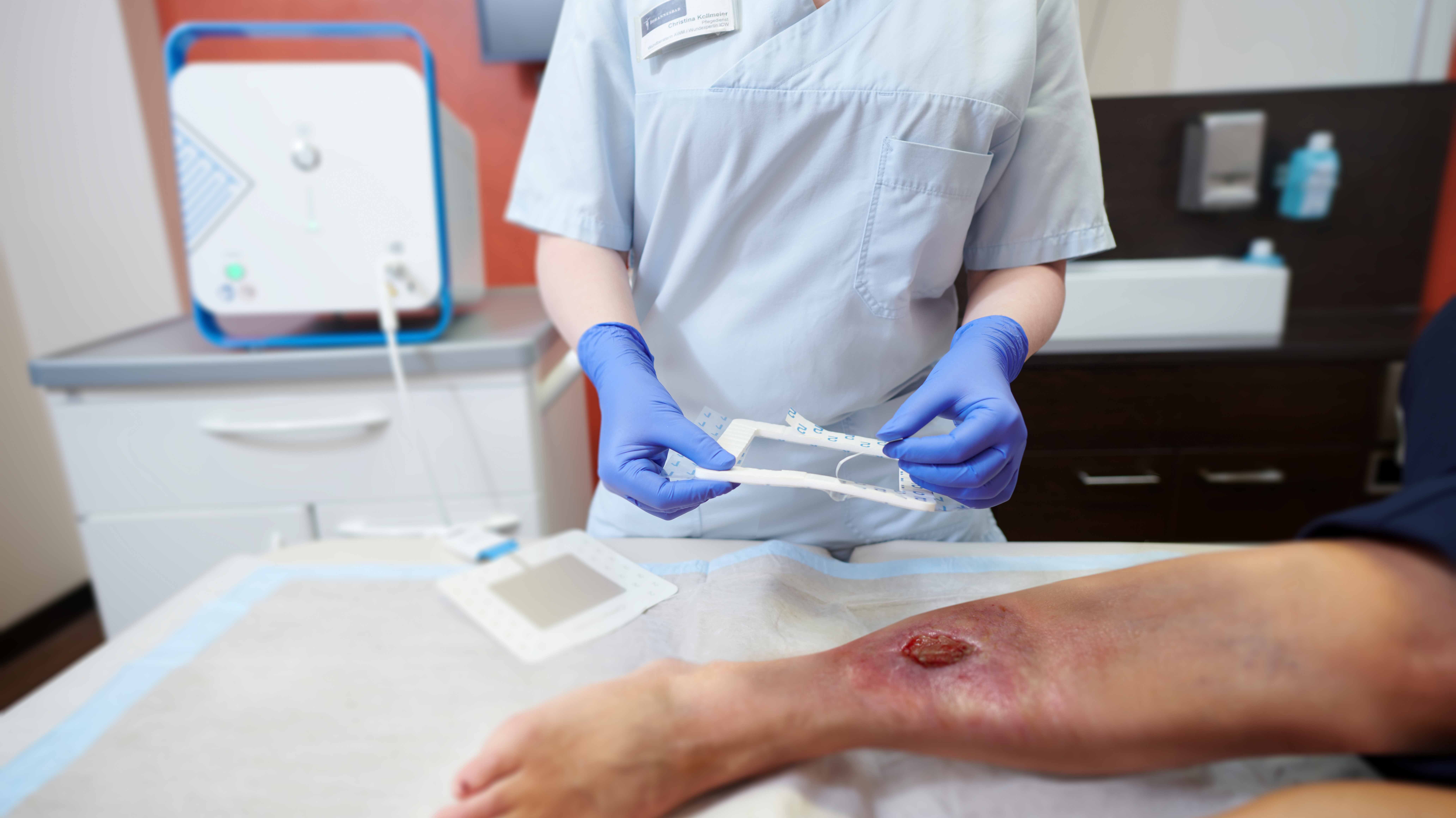
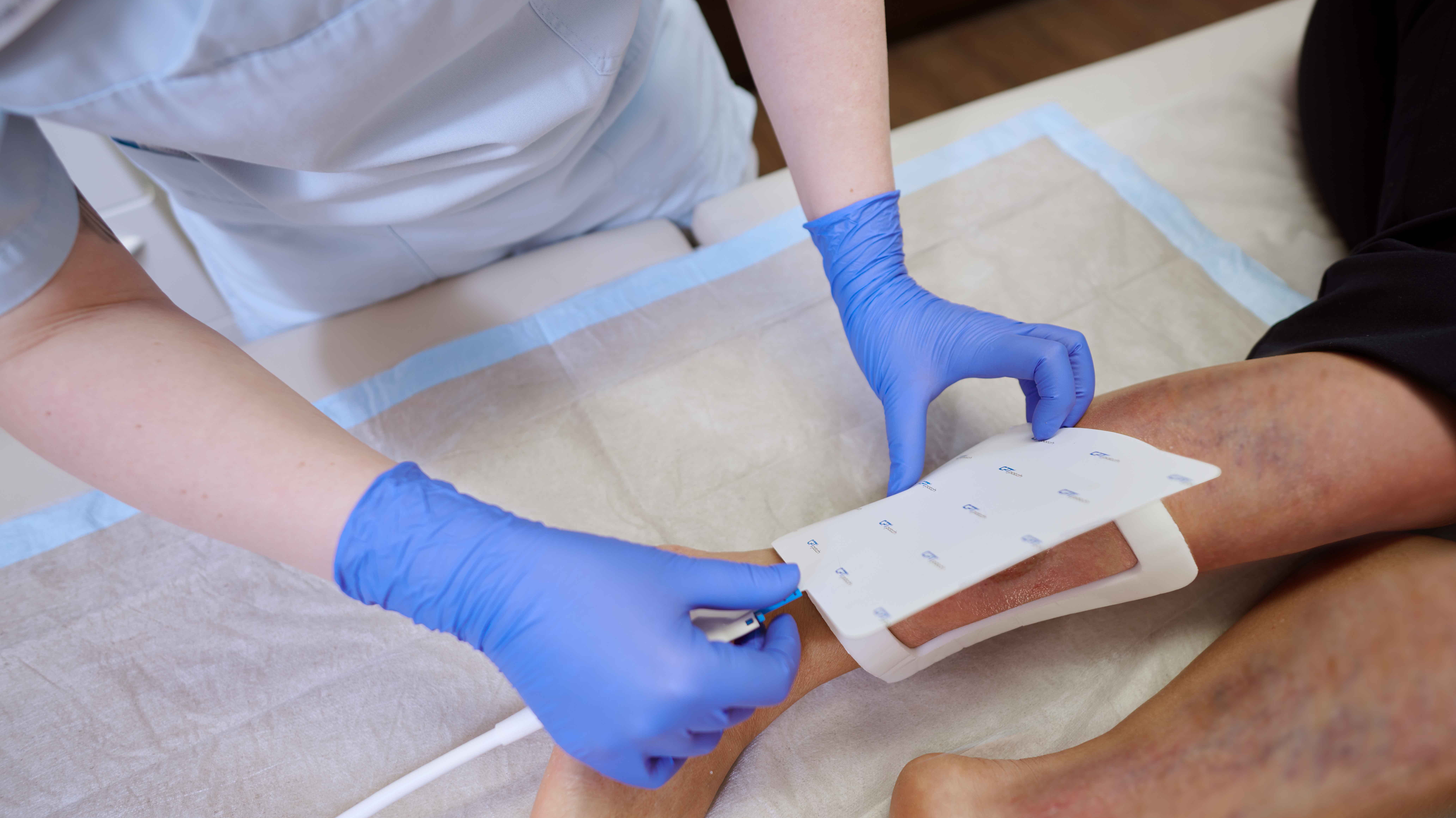
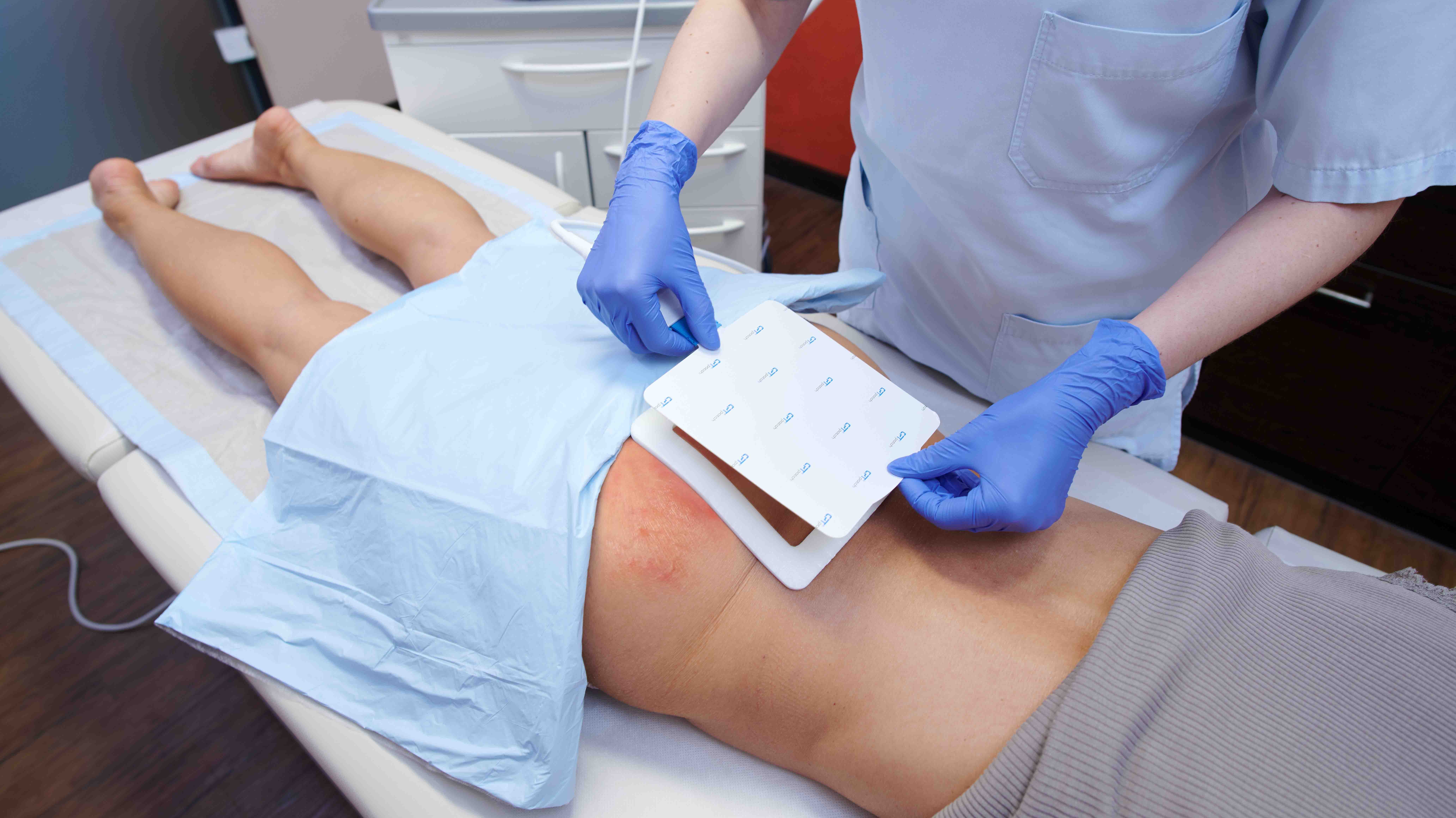
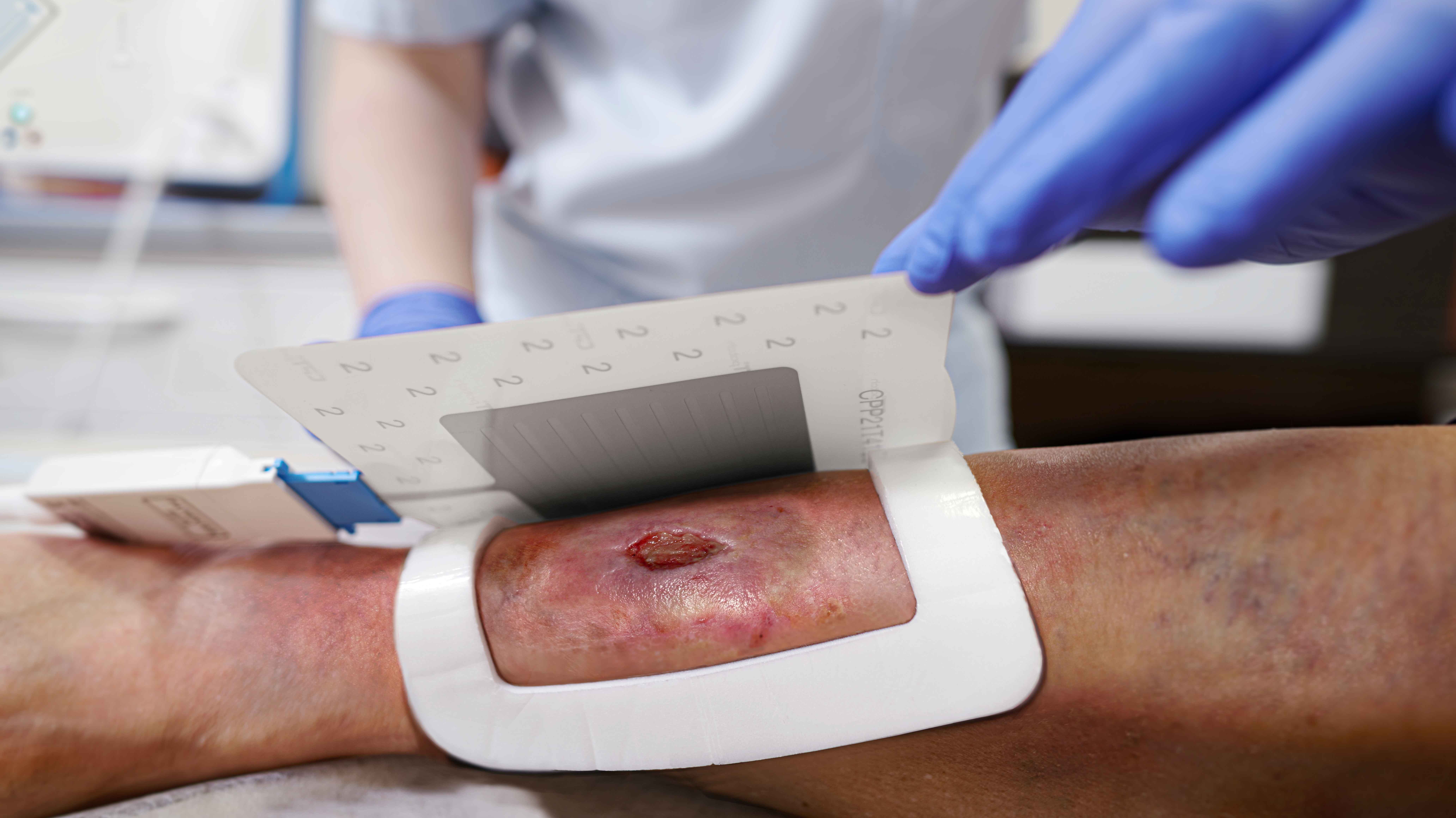
Die Behandlung mit dem CPT®PATCH
- Die Applikation der Wundauflage ist einfach und sicher
- Zur Behandlung ist ein CPT®patch auf das Wundareal aufzukleben und mittels des CPT®cube zu betreiben.
- Die Behandlung dauert 2 Minuten.
- Die Behandlung kann und sollte gemäß Ermessen des behandelnden Arztes oder der behandelnden Ärztin adjuvant zu anderen Therapieformen bzw. Empfehlungen der entsprechenden Leitlinien angewendet werden.
- Im Anschluss an die Plasmabehandlung erfolgt die Abdeckung der Wunde mit handelsüblichen Wundauflagen.
Ergebnisse klinisch dermatologischer Untersuchungen
- Inaktivierung von heilungshemmenden Wundkeimen, inklusive MRSA
- Keine Resistenzbildung
- Erhöhung der Mikrozirkulation im Gewebe
- Förderung der Angiogenese
- Anregung der Wundheilung unabhängig der Wundarchitektur
- Senkung des pH-Wertes im Wundbereich
- Zeitnaher Wirkungseintritt
- Schmerzarme Behandlung
Die Wirkkomponenten
Auszug Positionspapier zum Risikopotenzial und zu Anwendungsperspektiven von kaltem Atmosphärendruckplasma in der Medizin, NZPM:
- Nach gegenwärtigem internationalem Stand der Forschung sind wesentliche Wirkkomponenten von kalten Atmosphärendruckplasmen reaktive Stickstoff- und Sauerstoffspezies (RNS, ROS), UV-Strahlung und elektrische Felder.
- Reaktive Stickstoff- und Sauerstoffspezies (RNS, ROS) werden durch Einkopplung von elektrischer Energie in an sich nicht biologisch wirksame Gase (Argon, Helium, Stickstoff, Sauerstoff, Luft sowie Gemische daraus) sowie anschließende Wechselwirkung mit angrenzenden Medien (atmosphärische Luft, Flüssigkeiten, Oberflächen) kurzzeitig und lokal gebildet. Grundsätzlich werden dieselben reaktiven Spezies mitunter auch im menschlichen Körper im Rahmen des normalen Stoffwechsels produziert und haben teilweise wichtige Funktionen zur Steuerung und Vermittlung physiologischer und pathologischer Prozesse. Kurzzeitig erhöhte Dosen dieser RNS und ROS können durch körpereigene Systeme wirksam entgiftet werden.
- UV-Strahlung wird medizinisch u.a. in der Phototherapie und Photochemotherapie eingesetzt. In diesem Zusammenhang sowie unter dem Aspekt des allgemeinen Personen- und Arbeitsschutzes auch außerhalb des medizinischen Umfeldes sind für UV-Belastungen Grenzwerte festgelegt worden, die im Zusammenhang mit der Anwendung von kaltem Atmosphärendruckplasma deutlich unterschritten werden.
Wichtige Erkenntnisse der plasmamedizinischen Grundlagenforschung der vergangenen Jahre
Plasmaeffekte
Biologische Plasmaeffekte an Zellen und im Gewebe werden über Veränderungen der flüssigen Zellumgebung vermittelt.
ROS und RNS
Für durch Plasmaeinwirkung induzierte biologische Effekte spielen in die Flüssigkeit eingetragene bzw. in der Flüssigkeit gebildete oxidierende Spezies, sog. reaktive Sauerstoff- und Stickstoffspezies (ROS, RNS) eine dominierende Rolle.
Dieselben reaktiven Spezies (ROS, RNS) werden auch im menschlichen Körper im Rahmen des normalen Stoffwechsels produziert und haben teilweise wichtige Funktionen zur Steuerung und Vermittlung physiologischer und pathologischer Prozesse. Die wichtigsten ROS und RNS sind Hydroxylradikal (OH•), Wasserstoffperoxid (H2O2), Superoxid bzw. Hyperoxid (O2-•), Stickstoffmonoxid (NO•), Stickstoffdioxid (NO2•) und Peroxynitrit (ONOO-). Sie spielen beispielsweise eine wichtige Rolle im Rahmen von Wundheilungsprozessen. Diese Erkenntnis liefert eine wesentliche wissenschaftliche Basis für das Konzept der plasmaunterstützten Wundheilung, bei dem neben der bekannten antibakteriellen/desinfizierenden Plasmawirkung auch eine Stimulation der Geweberegeneration durch Plasmaeinwirkung erreicht werden soll.
Ein Mechanismus der Plasmawirkung beruht somit auf der Unterstützung körpereigener Funktionen, die – etwa im Falle nicht heilender chronischer Wunden – durch krankheitsbedingte Störungen nicht ausreichend wirksam werden können. Darüber hinaus ist bekannt, dass in menschlichen Zellen immer eine gewisse Grundkonzentration von RNS und ROS vorhanden ist. Aufgrund des physiologischen Vorkommens dieser Spezies können kurzzeitig erhöhte Konzentrationen durch körpereigene Systeme wirksam entgiftet werden [16-24]. Mittels Transkriptomanalysen von in-vitro plasmabehandelten humanen Zellen konnte gezeigt werden, dass mit der zellulären Stressantwort assoziierte Gene infolge der Plasmabehandlung verstärkt hochregulierte und antioxidativ aktive Enzyme gebildet werden [25].
Da Plasmabehandlungen lokal und zeitlich begrenzt sind, ist unter normalen Bedingungen davon auszugehen, dass das mit einem Eintrag dieser ROS und RNS in das Gewebe einhergehende Nebenwirkungsrisiko außerordentlich gering ist.
Ultraviolette Strahlung (UV-Strahlung)
Vor allem UV-B-Strahlung wird in der Dermatologie im Rahmen der Phototherapie eingesetzt. Entsprechend den Empfehlungen der Deutschen Dermatologischen Gesellschaft (DDG) zur Phototherapie und Photochemotherapie werden für Breitspektrum-UV- B-Anwendung (280-320 nm) in Abhängigkeit vom Hauttyp Initialdosen zwischen 20 und 60 mJ/cm2 empfohlen, für Schmalspektrum-UV-B-Behandlung (311 nm) Dosen zwischen 200 und 600 mJ/cm/WTA.
Ein Vergleich mit der Sonneneinstrahlung zeigt, dass die von den bisher in klinischen Testungen angewendeten bzw. als Medizinprodukte zugelassenen kalten Atmosphärendruckplasmaquellen emittierte UV-Intensität weit unter der des Sonnenlichtes liegt.
Für die derzeit als Medizinprodukte zertifizierten Plasmaquellen konnte gezeigt werden, dass unter den empfohlenen Anwendungsbedingungen (Arbeitsabstand, Behandlungszeit) die maximal zulässige UV-Tagesdosis deutlich unterschritten wird.
Elektrische Felder
Elektrische Felder lassen sich zunächst in Gleich- und Wechselfelder unterteilen. Darüber hinaus ermöglicht die Pulsung solcher Signale sowie eine mono- oder bi-phasige Modulation eine hohe parametrische Diversität. Technische Frequenzen liegen im Bereich einiger Hz bis in den GHz-Bereich. Geräte, die ausschließlich mit elektrischen Felder arbeiten, sind seit vielen Jahren zur Anwendung im und am menschlichen Körper etabliert und können als Folge der elektrischen Felder einen elektrischen Stromfluss in biologischem Gewebe hervorgerufen.
Geräteunabhängig bietet der Einsatz von elektrischen Signalen zur Elektrostimulation eine Vielzahl von nachgewiesenen Anwendungsbereichen in der medizinischen Versorgung. So kann z.B. die Zellbewegung von Immunzellen (Makrophagen und Granulozyten) sowie die Migration von Hautzellen (Keratinozyten) und Cornea-Epithel als Reaktion auf ein elektrisches Feld gezielt beeinflusst werden, das Proliferationsverhalten von Bindegewebszellen (Fibroblasten) wird angeregt und für die Gefäßneubildung (Angiogenese) und das Nervenwachstum ist das elektrische Feld ebenfalls von Bedeutung. Schließlich haben In-vivo-Untersuchungen unter Verwendung elektrischer Felder eine antibakterielle Wirkung sowohl auf gram-negative als auch auf gram-positive Bakterien gezeigt.
In den letzten Jahren konnte die Forschung im Gebiet der Bioelektrizität signifikante Verbindungen zwischen endogenen elektrischen Feldern und dem Wundheilungsprozess darlegen. Eine Metaanalyse von Gardner et al. wurde unter Verwendung der Datensätze aus 15 klinischen Studien mit dem Ziel erstellt, die Wirkung der Elektrostimulation (ES) auf die Heilung von chronischen Wunden zu quantifizieren. Bei Behandlungen mit ES wurde eine Wundreduktion von durchschnittlich 22,2% pro Woche erreicht, während bei den Kontrollgruppen lediglich ein Wert von 9,1% zu beobachten war.
In den veröffentlichten Teilergebnissen des Cochrane Review #077 wurde der Heilungserfolg (Wundverschluss) unter Anwendung von Elektrostimulation mit der Placebo-Kontrolle verglichen. Diese Fragestellung wurde in 13 der 20 Studien untersucht. Die Auswertung zeigte, dass durch die Behandlung mit Elektrostimulation (verum) doppelt so viele (OR=2,12; 95% CI: 1,55 – 2,90) Wunden geheilt werden konnten wie bei den Kontrollen.
Studienlage zu kaltem Plasma
Nebenwirkungen/Verträglichkeit von kaltem Plasma
Zum derzeitigen Stand der klinischen Forschung sind keine klinisch relevanten Nebenwirkungen bekannt.
Eine umfangreiche Studienlage zeigt die Wirksamkeit
Die antimikrobielle Wirksamkeit wurde durch weitere Studien bestätigt. So erfolgte die Behandlung chronischer Wunden von 34 Patient:innen mit kaltem Plasma oder in Kombination mit einem Wundantiseptikum. Dabei zeigte die Kombinationstherapie die beste Wirksamkeit [1].
In einer monozentrischen, randomisiert-kontrollierten klinischen Studie wurden jeweils sieben Patient:innen mit mindestens 12 Wochen alten, chronischen Ulzera einer oder keiner Plasmabehandlung zusätzlich zur normalen Wundbehandlung unterzogen. Als Plasmaquelle diente eine dielektrisch-behinderte und mit Luft betriebene Entladung. Die Wundheilung erfolgte ähnlich gut wie bei der Standardtherapie, während sich die mit Bakterien kolonisierten Wundflächen bei den mit Palsma behandelten Wunden im Mittel um 88 % verkleinerten [2].
In einer weiteren Studie mit fünf Proband:innen wurden auf beiden Armen jeweils zwei künstliche Wunden mittels Unterdrucks erzeugt und der Heilungsverlauf beobachtet. Die vier Wunden erhielten entweder keine Behandlung (A) eine Behandlung mit kaltem Plasma (B), Octenisept© (C) oder eine Plasmabehandlung gefolgt von einer Behandlung mit Octenisept© (D). Normiert auf die initiale Fläche heilten die mit Plasma behandelten Wunden (B) an allen gemessenen Zeitpunkten am schnellsten, während die unbehandelten Wunden (A) am langsamsten heilten [3].
Sechzehn in die Studie eingeschlossene Patient:innen (zehn Frauen und sechs Männer) mit chronischen Bein-Ulcera wurden jeweils dreimal wöchentlich über einen Zeitraum von zwei Wochen mit kaltem Plasma behandelt. Neben der Messung der antimikrobiellen Aktivität war es das Ziel der Studie, den Effekt auf die Wundheilung zu untersuchen.
Die hierbei verglichenen Parameter waren, neben der Anzahl der Bakterienkolonien pro Quadratzentimeter auch die Größe der Wundoberfläche und die Veränderung des Wundvolumens. Die Autor:innen schlussfolgern, dass der unmittelbare, antimikrobielle Effekt der beiden Behandlungsmethoden weitestgehend vergleichbar ist. Die Plasmatherapie wurde von den Patient:innen sehr gut toleriert und wird nach Aussage der Autor:innen aufgrund ihres physikalischen Wirkprinzips wahrscheinlich keine Allergien auslösen [4].
In einer umfangreicheren Studie mit 70 Patient:innen konnte an mit kaltem Plasma behandelten, chronischen Ulzera – im Vergleich zu unbehandelten Wunden – eine Tendenz zur verbesserten Heilung bestimmt werden [5]. Außerdem konnte in einer weiteren, randomisiert-kontrollierten Studie mit 40 Patient:innen eine signifikant verbesserte Heilung nach Plasmabehandlung von akuten Wunden nach Hauttransplantationen festgestellt werden [6]. Eine Zusammenfassung des gegenwärtigen Standes der Plasmaanwendung in Tierexperimenten, in-vivo, sowie klinischen Studien und Fallberichten ist ebenfalls Gegenstand einer aktuellen Übersichtsarbeit [7].
Eine Risikoabschätzung mit Bezug auf Plasmaspezies (Temperatur, UV-Strahlung und freie Radikale) ergab dabei keine erhöhten Risiken für den Menschen [8].
Aufgrund des erreichten Standes der klinischen Forschung haben Plasmaanwendungen in der Dermatologie sowie der plastischen und ästhetischen Chirurgie gegenwärtig die höchsten Erfolgsaussichten. Dabei stehen die Nutzung antimikrobieller Plasmaeffekte, die plasmaunterstützte Stimulierung der Geweberegeneration sowie entzündungsmodulierende Plasmawirkungen im Fokus therapeutischer Indikationen.
Literaturverzeichnis
[1] M. Klebes, C. Ulrich, F. Kluschke, A. Patzelt, S. Vandersee, H. Richter, A. Bob, J. Hutten, J.T. Krediet, A. Kramer, Combined antibacterial effects of tissue‐tolerable plasma and a modern conventional liquid antiseptic on chronic wound treatment, Journal of biophotonics, 8 (2015) 382-391.
[2] F. Brehmer, H. Haenssle, G. Daeschlein, R. Ahmed, S. Pfeiffer, A. Görlitz, D. Simon, M. Schön, D. Wandke, S. Emmert, Alleviation of chronic venous leg ulcers with a hand‐held dielectric barrier discharge plasma generator (PlasmaDerm® VU‐2010): results of a monocentric, two‐armed, open, prospective, randomized and controlled trial (NCT01415622), Journal of the European Academy of Dermatology and Venereology, 29 (2015) 148-155.
[3] S. Vandersee, H. Richter, J. Lademann, M. Beyer, A. Kramer, F. Knorr, B. Lange-Asschenfeldt, Laser scanning microscopy as a means to assess the augmentation of tissue repair by exposition of wounds to tissue tolerable plasma, Laser Physics Letters, 11 (2014) 115701.
[4] C. Ulrich, F. Kluschke, A. Patzelt, S. Vandersee, V. Czaika, H. Richter, A. Bob, J. von Hutten, C. Painsi, R. Hügel, Clinical use of cold atmospheric pressure argon plasma in chronic leg ulcers: A pilot study, Journal of wound care, 24 (2015).
[5] G. Isbary, W. Stolz, T. Shimizu, R. Monetti, W. Bunk, H.U. Schmidt, G.E. Morfill, T.G. Klämpfl, B. Steffes, H.M. Thomas, J. Heinlin, S. Karrer, M. Landthaler, J.L. Zimmermann, Cold atmospheric argon plasma treatment may accelerate wound healing in chronic wounds: Results of an open retrospective randomized controlled study in vivo, Clinical Plasma Medicine, 1 (2013) 25-30.
[6] J. Heinlin, J.L. Zimmermann, F. Zeman, W. Bunk, G. Isbary, M. Landthaler, T. Maisch, R. Monetti, G. Morfill, T. Shimizu, J. Steinbauer, W. Stolz, S. Karrer, Randomized placebo-controlled human pilot study of cold atmospheric argon plasma on skin graft donor sites, Wound Repair Regen, 21 (2013) 800-807.
[7] T. Von Woedtke, H.R. Metelmann, K.D. Weltmann, Clinical plasma medicine: state and perspectives of in vivo application of cold atmospheric plasma, Contributions to Plasma Physics, 54 (2014) 104-117.
[8] J. Lademann, H. Richter, A. Alborova, D. Humme, A. Patzelt, A. Kramer, K.-D. Weltmann, B. Hartmann, C. Ottomann, J.W. Fluhr, Risk assessment of the application of a plasma jet in dermatology, Journal of biomedical optics, 14 (2009) 054025-054025-054026.
Sagawa et al., Argon plasma coagulation for successful treatment of early gastric cancer with intramucosal invasion. Gut 52 (2003) 334-339 J. Vargo, Clinical applications of the argon plasma coagulator. Gastrointestinal Endoscopy 59 (2004) 81-88 Raiser, M. Zenker. Argon plasma coagulation for open surgical and endoscopic applications: state of the art. J. Phys. D: Appl. Phys. 39 (2006) 3520-3523 Manner et al., Safety and efficacy of a new high power argon plasma coagulation system (hp-APC) in lesions of the upper gastrointestinal tract. Digestive and Liver Disease 38 (2006) 471-478 Manner et al., Second-generation argon plasma coagulation: Two-center experience with 600 patients. J. Gastroenterol. Hepatol. 23 (2008) 872-878 Zenker, Argon plasma coagulation. GMS Krankenhaushyg. Interdiszip. 3 (2008)Doc15 Keller et al., Electrical and spectroscopic characterization of a surgical argon plasma discharge. J. Phys. D: Appl. Phys. 46 (2013) 025402 Keller, Charakterisierung der Argonplasma-Koagulation (APC) für die thermische Behandlung von biologischem Gewebe in der Endoskopie und der Chirurgie. Dissertation zur Erlangung des Grades eines Doktor-Ingenieurs an der Fakultät für Elektrotechnik und Informationstechnik, Ruhr-Universität Bochum 2012 Ianelli et al., Use of PlasmaJet System in patients undergoing abdominal lipectomy following massive weight loss resulting from bariatric surgery: early experience. Obes. Surg. 16 (2006) 1504-1507 Nezhat et al., Use of neutral argon plasma in the laparoscopic treatment of endometriosis. J. Soc. Laparoendsocop. Surg. 13 (2009) 479-483 K. Madhuri, et al., First clinical experience of argon neutral plasma energy in gynaecological surgery in the UK. Gynaecol. Surg. 7 (2010) 423-425 A. Bogle et al., Evaluation of plasma skin regeneration technology in low-energy full-facial rejuvenation. Arch. Dermatol. 143 (2007) 168-174 Kilmer et al., A pilot study on the use of a plasma skin regeneration device (Portrait PSR3) in full facial rejuvenation procedures. Lasers Med. Sci. 22 (2007) 101-109 D. Holcomb et al., Nitrogen plasma skin regeneration and aesthetic facial surgery. Arch. Facial Plast. Surg. 11 (2009) 184-193 Wade Forster et al., Advances in plasma skin regeneration (Review article). J. Cosmetic Dermatol. 7 (2008) 169-179 Dröge, Free radicals in the physiological control of cell function. Physiol. Rev. 82 (2002) 47-95 C. Fang, Antimicrobial reactive oxygen and nitrogen species: concepts and controversies. Nature Rev. Microbiol. 2 (2004) 820-832 G. Rhee, H2O2, a necessary evil for cell signaling. Science 312 (2006) 1882-1883 O. Lundberg et al., The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Rev. Drug Discov. 7 (2008) 156-168 K. Sen and S. Roy, Redox signals in wound healing (invited review). Biochim. Biophys. Acta 1780 (2008) 1348-1361 K. Sen, Wound healing essentials: let there be oxygen (perspective article). Wound Rep. Regen. 17 (2009) 1-18 Leonarduzzi et al., Targeting tissue oxidative damage by means of cell signaling modulators: the antioxidant concept revisited. Pharmacology & Therapeutics 128 (2010) 336-374 B. Graves, The emerging role of reactive oxygen and nitrogen species in redox biology and some implications for plasma applications to medicine and biology (topical review). J. Phys. D: Appl. Phys. 45 (2012) 163001 von Woedtke et al., Plasmas for medicine. Phys. Rep. 530 (2013) 291-320 Schmidt et al. Non-thermal plasma treatment is associated with changes in transcriptome of human epithelial skin cells. Free Radical Res. 47 (2013) 577-592 Kramer, O. Assadian (Eds.), Praxis der Sterilisation, Desinfektion, Antiseptik und Konservierung, Thieme, Stuttgart 2008, S. 719 ff. Fachverband für Strahlenschutz e.V., Leitfaden „Ultraviolettstrahlung künstlicher Quellen“ (FS-2013-157-AKNIR, Stand 28.3.2013); osiris22.pi-consult.de/userdata/l_20/p_105/library/data/fs-05-131-aknir_uv_strahlung.pdf Richtlinie 2006/25/EG des Europäischen Parlamentes und des Rates vom 5. April 2006 über Mindestvorschriften zum Schutz von Sicherheit und Gesundheit der Arbeitnehmer vor der Gefährdung durch physikalische Einwirkungen (künstliche optische Strahlung); eur-lex.europa.eu/LexUriServ/LexUriServ.do ICNIRP Statement. Guidelines on UV radiation exposure limits. Health Physics 87 (2004) 171 Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF), AWMF-Leitlinienregister Nr. 013/029, Empfehlungen der Deutschen Dermatologischen Gesellschaft (DDG) zur UV-Phototherapie und Photochemotherapie, Stand: 12/2009; www.awmf.org/uploads/tx_szleitlinien/013-029.pdf Lademann et al., Risk assessment of the application of a plasma jet in dermatology. J. Biomed. Opt. 14 (2009) 054025 Heinlin et al., Plasma applications in medicine with a special focus on dermatology. J. Eur. Acad. Venereol. 25 (2011) 1-11 Isbary et al., Successful and safe use of 2 min cold atmospheric argon plasma in chronic wounds: results of a randomized controlled trial Br. J. Dermatol. 167 (2012) 404-410 Rajasekaran et al., Characterization of Dielectric Barrier Discharge (DBD) on Mouse and Histological Evaluation of the Plasma-Treated Tissue. Plasma Process. Polym. 8 (2011) 246-255 Bussiahn et al., Plasmaquellen für biomedizinische Applikationen. Hyg. Med. 38 (2013) 212-216 R. Cho et al., Integrin-Dependent Human Macrophage Migration Induced by Oscillatory Electrical Stimulation Ann. Biomed. Eng. 28 (2000) 234-243 Goldman, S. Pollack, Electric fields and proliferation in a chronic wound model. Bioelectromagnetics 17 (1996) 450-457 Song et al., Nerve regeneration and wound healing are stimulated and directed by an endogenous electrical field in vivo. J. Cell Sci. 117 (2004) 4681-4690 E. Pullar et al., β4 Integrin and Epidermal Growth Factor Coordinately Regulate Electric Field-mediated Directional Migration via Rac1. Mol. Biol. Cell 17 (2006) 4925-4935 Daeschlein et al., Antibacterial activity of positive and negative polarity low-voltage pulsed current (LVPC) on six typical Gram-positive and Gram-negative bacterial pathogens of chronic wounds. Wound Repair Regen. 15 (2007) 399-403 C. Recio et al., High-voltage Electrical Stimulation for the Management of Stage III and IV Pressure Ulcers among Adults with Spinal Cord Injury: Demonstration of its Utility for Recalcitrant Wounds below the Level of Injury, J. Spinal Cord. Med. 35 (2012) 58-63 E. Houghton et al., Electrical Stimulation Therapy increases rate of healing of Pressure Ulcers in Community-Dwelling People with Spinal Cord Injury, Arch. Phys. Med. Rehabil. 91 (2010) 669-678 Adunsky et al. Decubitus Direct Current Treatment of Pressure Ulcers: Results of a Randomized, Double-Blind, Placebo-controlled Study, Arch. Gerontol. Geriatr. 41 (2005) 261-269 E. Gardner et al., Effect of electrical stimulation on chronic wound healing: a meta-analysis. Wound Repair Regen. 7 (1999) 495–503 Koel und F. Oosterveld. Review. Electrotherapy for stimulation of wound healing. EWMA Journal 9 (2009) 57 DIN EN 60601-1. Medizinische elektrische Geräte – Teil 1: Allgemeine Festlegungen für die Sicherheit einschließlich der wesentlichen Leistungsmerkmale. Ausgabedatum 2013-12 ICNIRP Statement. Guidelines for limiting exposure to time-varying electric, magnetic, and electromagnetic fields (up to 300 GHz). Health Physics 97 (2009) 257-258 Isbary et al., Ex vivo human skin experiments for the evaluation of safety of new cold atmospheric plasma devices. Clin. Plasma Med. 1 (2013) 36-44 Kalghatgi et al., Effects of Non-Thermal Plasma on Mammalian Cells. PLoS ONE 6 (2011) e16270 OECD 476/1997: OECD Guidelines for the testing of chemicals. In Vitro Mammalian Cell Gene Mutation Test; www.oecd.org/chemicalsafety/risk-assessment/1948426.pdf Boxhammer et al., Investigation of the mutagenic potential of cold atmospheric plasma at bactericidal dosages. Mutation Res. 753 (2013) 23-28 Arndt et al. Cold Atmospheric Plasma (CAP) Changes Gene Expression of Key Molecules of the Wound Healing Machinery and Improves Wound Healing In Vitro and In Vivo. PloS One 8 (2013) e79325 Isbary et al., A first prospective randomized controlled trial to decrease bacterial load using cold atmospheric argon plasma on chronic wounds in patients. Brit. J. Dermatol. 163 (2010) 78-82 Isbary et al., Cold atmospheric plasma: A successful treatment of lesions in Hailey-Hailey disease. Arch. Dermatol. 147 (2011) 388-390 Isbary et al., Non-thermal plasma—More than five years of clinical experience. Clin. Plasma Med. 1 (2013) 19-13 Isbary et al., Cold atmospheric argon plasma treatment may accelerate wound healing in chronic wounds: results of a retrospective in vivo randomized controlled study. Clin. Plasma Med. 2 (2013) 25-30 Isbary et al., Cold atmospheric plasma for local infection control and subsequent pain reduction in a patient with chronic post-operative ear infection. New Microb. New Inf. 3 (2013) 41-43 Heinlin et al., A randomized two-sided placebo-controlled study on the efficacy and safety of atmospheric non-thermal argon plasma for pruritus. J. Eur. Acad. Dermatol. Venereol. 27 (2013) 324-331 Heinlin et al., Randomized placebo-controlled human pilot study of cold atmospheric argon plasma on skin graft donor sites. Wound Rep. Regen. 21 (2013) 800-807 -R. Metelmann et al., Experimental Recovery of CO2-Laser Skin Lesions by Plasma Stimulation. Am. J. Cosmetic Surg. 29 (2012) 52-56 -R. Metelmann et al., Scar formation of laser skin lesions after cold atmospheric pressure plasma (CAP) treatment: A clinical long term observation Clin. Plasma Med. 1 (2013) 30-35 Emmert et al., Atmospheric pressure plasma in dermatology: Ulcus treatment and much more. Clin. Plasma Med. 1 (2013) 24-29 Tiede et al., Plasma applications: a dermatological view. Contrib. Plasma Phys. 54 (2014) 118-130 Emmert et al., Treatment of Chronic Venous Leg Ulcers with a Hand-Held DBD Plasma Generator. Plasma Medicine (2014) DOI: 10.1615/PlasmaMed.2013005914 Lademann et al., Risk assessment of the application of tissue-tolerable plasma on human skin. Clin. Plasma Med. 1 (2013) 5-10 Kramer et al., Suitability of tissue tolerable plasmas (TTP) for the management of chronic wounds. Clin. Plasma Med. 1 (2013) 11-18 Clinical Plasma Medicine Core Group. Clinical plasma medicine – position and perspectives in2012. Paper of consent, result of the workshop “Clinical Concepts in Plasma Medicine”, Greifswald April 28th, 2012. Plasma Med. 1 (2013) 3-4 von Woedtke et al., Clinical Plasma Medicine: State and perspectives of in vivo application of cold atmospheric plasma. Contrib. Plasma Phys. 54 (2014) 104-117 Schlegel et al., Plasma in cancer treatment. Clin. Plasma Med. Vol. 1 No. 2 (2013) 2-7 Rupf et al. Removing biofilms from microstructured titanium ex vivo: a novel approach using atmospheric plasma technology. PLoS One. 10 (2011) e25893 A.N. Idlibi et al. Destruction of oral biofilms formed in situ on machined titanium (Ti) surfaces by cold atmospheric plasma. Biofouling 29 (2013) 369-79]
Anmeldung zur Plasmatherapie:
Johannesbad Wundzentrum
Johannesbad Fachklinik Bad Füssing
Johannesstr. 2, 94072 Bad Füssing
Tel. +49 8531 / 23-245
wundzentrum@johannesbad.com